
再生医療等を実施しようとする医療機関の管理者は、あらかじめ、再生医療等技術の区分ごとに再生医療等提供計画を作成し、厚生労働大臣(又は地方厚生局長)に提出することが義務付けられています。
再生医療等提供計画は、厚生労働省令により定められた「再生医療等提供基準」に適合している必要があります。
なお、再生医療等提供計画を提出しようとする際は、提出前に認定再生医療等委員会による審査を受け、委員会による意見を計画に添付する必要があります。
認定再生医療等委員会による審査は、計画が「再生医療等提供基準」に適合しているか否かを基準として行われます。
再生医療等は、リスクや新規性に応じて第1種~第3種の三つに分類され、分類ごとに計画提出の手続にも差異があります。
本稿では、再生医療等の分類及び分類ごとの手続の違いについて解説させていただきます。
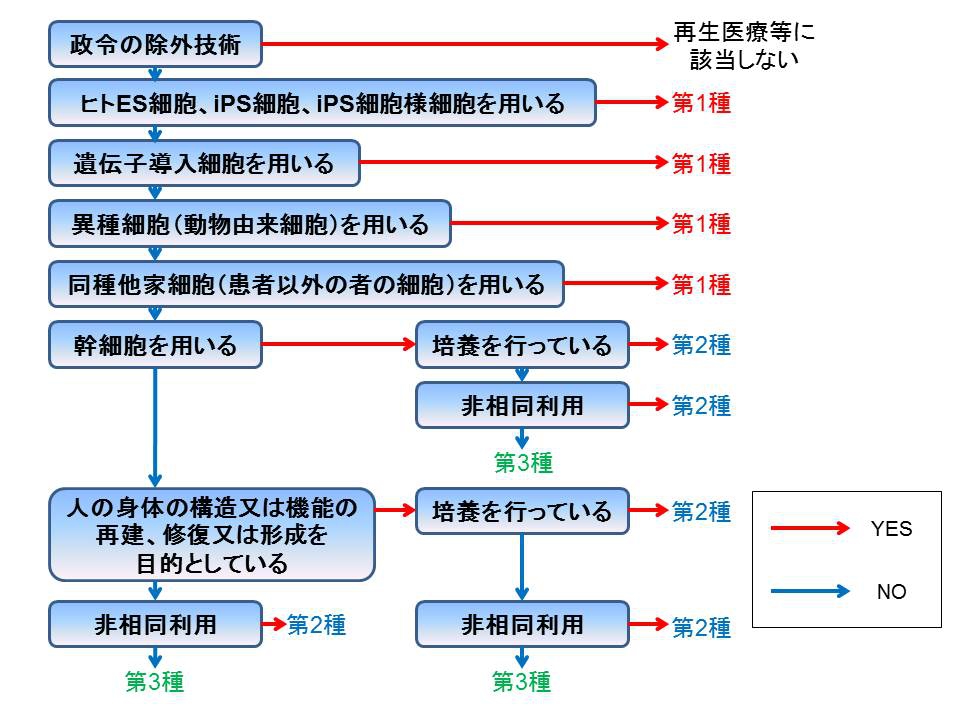
再生医療等はリスクや新規性に応じて第1種、第2種、第3種の三つに分類されています。
分類の決定は以下のフローチャートを用いて行われます。
第1種には、ES細胞やiPS細胞を用いる場合、遺伝子導入細胞を用いる場合など、新規性の非常に高い治療が該当し、今のところは臨床研究として実施する場合がほとんどであろうと思われます。
例えば、理化学研究所で行われているiPS細胞由来網膜色素上皮シート移植等が第1種に該当します。
第2種には、培養した幹細胞を用いる場合、身体の構造、機能の再建、修復、形成等を目的として培養細胞を用いる場合などが該当します。
例えば、脂肪由来幹細胞を用いた豊胸、しわ取り手術(細胞培養を伴う場合)などが第2種に該当します。
第3種には、第1種、第2種のどちらにも該当しない、比較的リスク、新規性が低い治療法が該当し、例としてはPRP療法(血液が豊富な組織に注入する場合)、がん免疫療法(遺伝子操作等を行わない場合)などが第3種に該当します。
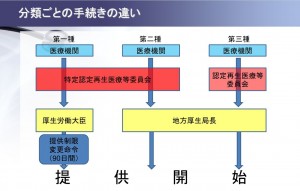
以上の分類によって、再生医療等提供計画提出に関する手続にも以下のような違いがあります。
第1種と第2種の再生医療等計画を提出する場合は、特に高い中立性、審査能力を持つ特定再生医療等委員会による審査を受ける必要があります。
さらに、第1種の場合は厚生労働大臣に計画を提出した後、原則90日間の間は当該再生医療等を提供することができず、その期間内は計画の変更命令を受ける可能性があります。
ご相談は無料ですので、お気軽にお問い合わせ下さい。
事前にご連絡をいただけましたら、営業時間外や休業日にも対応いたします。 また、チャットツールによる打ち合わせにも対応しております


