「再生医療等安全性確保法」に基づき、国内で実施される再生医療等に用いる特定細胞加工物を製造しようとする者は、施設ごとに地方厚生局長の許可を受ける必要があります。
ただし、①医療機関内に設置される場合、②医薬品医療機器等法に基づく再生医療等製品製造許可を受けた製造所、③臍帯血供給事業の許可を受けた者が臍帯血供給事業に用いる場合、のいずれかに該当する場合は、許可を受ける必要はなく、地方厚生局長への届出のみで足ります。
なお、外国の細胞培養施設において国内で実施される再生医療等に用いる特定細胞加工物を製造しようとする場合は厚生労働大臣による認定が必要となります。
特定細胞加工物製造許可の許可要件は以下の二点です。
- 細胞培養加工施設が厚生労働省令で定める構造設備の基準に適合していること。
- 申請者が欠格要件に該当しないこと。
本稿では、①の構造設備の基準について解説させていただきます。
細胞培養施設が適合していなければならない構造設備の基準は、厚生労働省令(再生医療等安全性確保法施行規則)により規定されています。(詳細はこちらからご覧ください。)
細胞培養施設の構造設備基準は、特に微生物等による汚染を防ぐことに重点が置かれた内容となっており、そのための差圧管理、清浄度管理、排水設備の整備等が要求されています。
基準を満たす細胞培養加工施設の例を以下に示します。
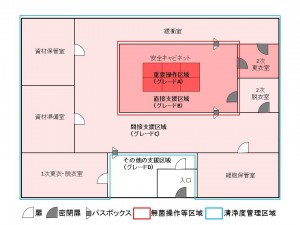
1.清浄度管理区域、無菌操作等区域
細胞培養施設内で以下の定義に当てはまる区域は清浄度管理区域に該当します。
清浄度管理区域:作業所のうち、特定細胞加工物等(無菌操作により取り扱う必要のあるものを除く。)の調製作業を行う場所及び滅菌される前の容器等が作業所内の空気に触れる場所
清浄度管理区域には排水溝を設置していないことなどが求められます(ただし、やむを得ない場合で、作業室の汚染を防止するために必要な構造である場合を除く)。
多くの場合、間接支援区域が清浄度管理区域に該当し、グレードC(ISO8)相当の清浄度を備えていることが一般的です。
また、以下の定義に当てはまる区域は無菌操作等区域に該当します。
無菌操作等区域:作業所のうち、無菌操作により取り扱う必要がある特定細胞加工物等の調製作業を行う場所、滅菌された容器等が作業所内の空気に触れる場所及び無菌試験等の無菌操作を行う場所
無菌操作等区域には排水溝、流しを設置していないことなどが求められます。
多くの場合、重要操作区域(安全キャビネット内)と直接支援区域が無菌操作等区域に該当し、グレードA(ISO5、重要操作区域)及びグレードB(ISO7、直接支援区域)の清浄度を備える施設が一般的です。
2.差圧管理
細胞培養加工施設では、微生物等による特定細胞加工物の汚染の防止のために適切な差圧管理が必要となります。
一般的には以下のように差圧の管理が行われます。
非管理区域<その他の管理区域(グレードD)<間接支援区域(グレードC)<直接支援区域(グレードB)<重要操作区域(グレードA)
ご相談は無料ですので、お気軽にお問い合わせ下さい。
事前にご連絡をいただけましたら、営業時間外や休業日にも対応いたします。 また、チャットツールによる打ち合わせにも対応しております


